来源: Science Advances
来源: Science Advances Sci Adv丨四川大学团队用癌症相关成纤维细胞表型调节的细胞外囊泡搭便车纳米脂质体阻碍了转移进展
转移是关键的肿瘤进展,缺乏有效的治疗策略,并且是癌症相关死亡率的主导因素,占所有癌症相关死亡的 90% 。此外,癌症相关成纤维细胞 (CAF) 是肿瘤和转移部位基质的显着组成部分,促进肿瘤和转移进展。考虑到 CAF 表型在肿瘤进展和转移中的显着作用,为远处转移部位的 CAFs 开发靶向和调节策略可能会促进转移治疗。
2025年7月9日,Science Advances 上发表四川大学何勤/李曼团队题为“Extracellular vesicle–hitchhiking nanoliposomes for cancer-associated fibroblast phenotype modulation impede metastasis progression ”的研究论文。受表达特异性整合素的肿瘤细胞外囊泡 (Evs) 对成纤维细胞的趋向性的启发,实验团队开发了一种用于肿瘤和肿瘤来源的 Evs 的标记策略。修饰的纳米脂质体,通过搭便车在这些标记的 EV 上,集中在远处转移部位的 CAF 中,同时靶向标记的肿瘤。这种 Ev-搭便车策略与负载药物 ATRA 和 lenvatinib 联合使用,有效调节 CAFs 的肌源性和炎症特性,重塑转移微环境,抑制肿瘤生长和转移。标记和 Ev 搭便车方法有望增强肿瘤消除和调节远处转移中的 CAFs 或其他 Ev 活化细胞,为癌症治疗提供潜在的突破。

在异质性和复杂的肿瘤或转移性微环境中,炎症和肌源性 CAFs 是普遍存在的、主要的 CAF 亚型,它们在许多肿瘤类型中占比最高,并具有多种功能。具有炎症特征的 CAFs 表现出活跃的炎症反应并促进肿瘤细胞增殖。具有肌源性特征的 CAFs 促进细胞外基质 (ECM) 调节和肿瘤细胞定植。抑制 CAFs 的炎症和成肌特性可能有助于转移治疗。临床上已应用的全反式维甲酸(ATRA,AT)和仑伐替尼(Le)可能通过维甲酸受体β(RAR-β)和成纤维细胞生长因子受体(FGFR)有效调控CAF表型,诱导肿瘤细胞凋亡。然而,同时靶向原发肿瘤、转移性肿瘤细胞和远处转移的CAFs的递送策略尚缺乏。近期研究表明,CAF靶向策略主要包括仿生膜策略、CAF特征抗体修饰和靶向肽修饰,但这些策略对CAFs缺乏选择性,且缺乏肿瘤清除的有效性。
细胞来源的细胞外囊泡(Evs;包括外泌体和微囊泡)促进癌症中的远距离细胞间通讯。高转移性肿瘤细胞来源的Evs具有对远处转移中特定器官或细胞类型的趋向性(以下提及的Evs均指肿瘤Evs)。整合素 (ITG) α6β4 高表达的肿瘤 Evs 表现出对肺成纤维细胞的趋向性,并可能促进远处转移中 CAFs 的靶向调控。此外,Evs 激活受体细胞,包括肺成纤维细胞、淋巴管内皮细胞和巨噬细胞,有利于转移进展,尤其是转移前微环境 (PMN) 的形成。然而,抑制 Evs 的产生面临着不同机制的难题。靶向调控 Ev 激活的细胞是一种有效的替代方法。作者假设纳米药物搭乘并追踪 Evs 可能促进远处转移中 CAFs 或其他 Ev 激活的细胞的调节。
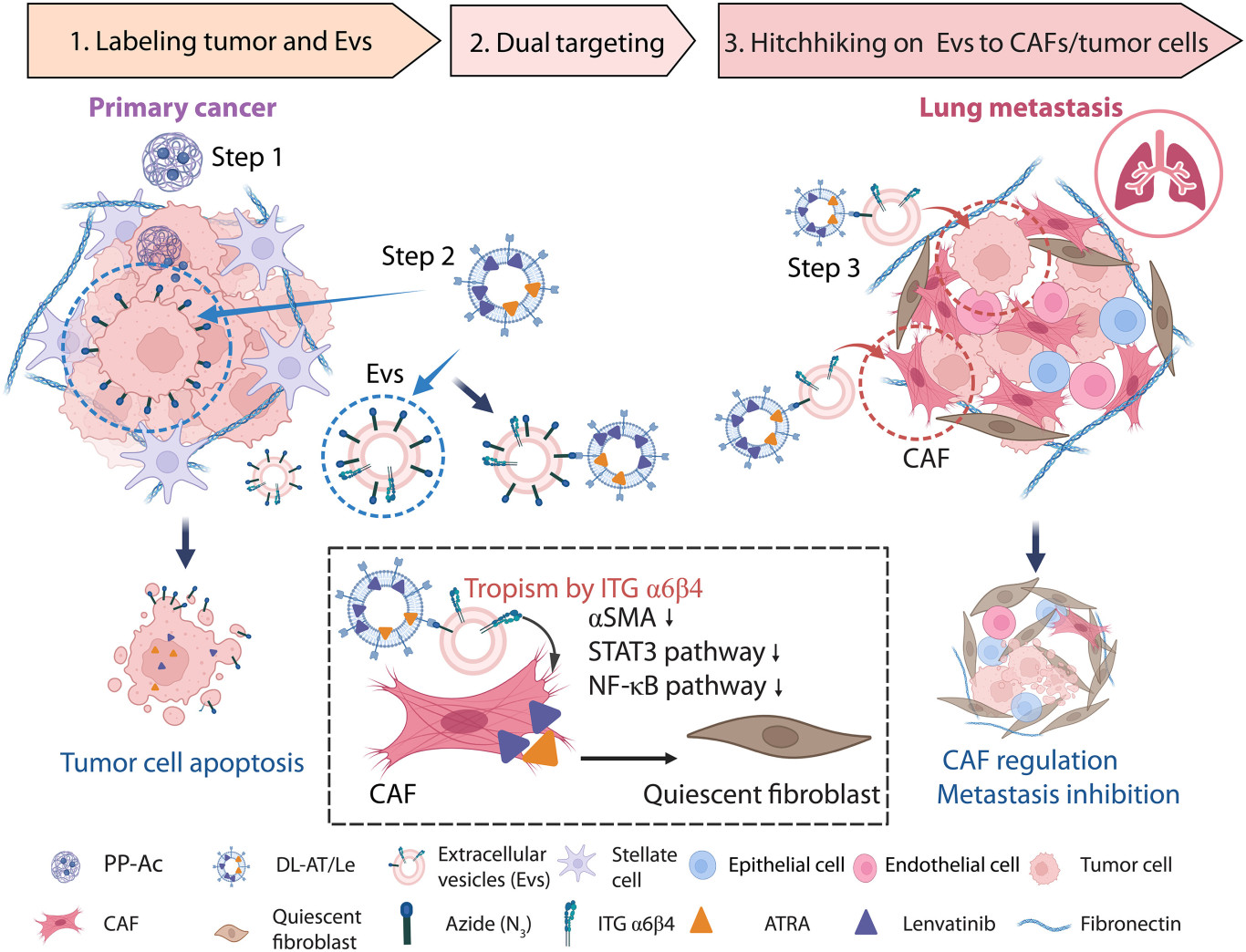
在此,受 Ev 对肺成纤维细胞趋向性的启发,作者构建了一个两步 Ev-hitchhiking输送系统,以靶向原发肿瘤并特异性调节 CAF 表型以进行抗转移治疗。在步骤1中,负载四乙酰化N-叠氮乙酰基-d-甘露糖胺(Ac4ManNAz)的酸响应性胶束(PP-Ac)有效地用人工受体(叠氮基团)标记肿瘤和肿瘤Evs。在步骤2中,二苄基环炔(DBCO)修饰的纳米脂质体通过生物正交点击反应靶向人工受体。对于肿瘤,靶向标记肿瘤和药物组合的DBCO修饰的载药纳米脂质体(ATRA和仑伐替尼,DL-AT/Le)有效诱导肿瘤细胞凋亡。对于Evs,DL-AT/Le搭乘标记的Evs靶向转移性肿瘤细胞和远处转移中的CAFs。该策略有效调节远处转移中CAFs
原文链接:https://www.science.org/doi/10.1126/sciadv.adr5635
图片来源网络如有侵权请及时联系删除!