来源: Science
来源: Science>> 动态膜骨架构在神经元功能中的重要性 <<
超分辨率成像显示,神经元中的膜骨架呈现出周期性结构,肌动蛋白丝在神经突周围形成均匀间隔的环,相邻的环通过血影蛋白四聚体连接。这种被称为膜相关周期性骨架(MPS)的高度有序网络存在于多种神经元细胞类型中,并在动物物种中高度保守。它在多种神经元功能中发挥着重要作用,既可以作为信号平台,也能为轴突提供机械支撑。
细胞骨架为细胞提供机械支撑,同时也能让细胞根据环境变化进行自我重塑。膜相关周期性骨架(MPS)是神经元细胞骨架的一部分,主要存在于轴突中。研究人员利用活细胞超分辨率成像技术研究了MPS的动态变化。发现MPS具有显著的动态性,在轴突的大部分长度上会经历反复的分解和重组周期。从机制上讲,MPS的重塑受钙离子调节,涉及肌动蛋白稳定、钙蛋白酶依赖的蛋白水解以及蛋白激酶C介导的内收蛋白磷酸化。这些结果为理解细胞如何执行其最基本的活动提供了宝贵的见解。
2025年8月7日,哈佛大学庄小威团队在Science发表题目为“The membrane skeleton is constitutively remodeled in neurons by calcium signaling”的论文,揭示了MPS的动态变化,在功能上,MPS的动态变化增强了神经元的内吞作用。
细胞骨架结构在稳定性和可塑性之间呈现出一种有趣的矛盾,既要满足机械支撑等长期功能的需求,又要具备重塑能力以适应细胞不断变化的需求。例如,肌动蛋白、中间丝和微管会形成复杂且持久的结构,但这些结构也会不断地被重塑。在某些涉及强烈外部刺激的情况下,MPS会被主动降解,比如在G蛋白偶联受体(GPCR)激活、轴突退化以及突触活动刺激时。尽管这些观察结果表明MPS在特定情况下具有重塑能力,但它通常被认为是一种稳定的结构。
利用活细胞结构光照明显微镜(SIM)来探索MPS的动态变化,以及这些动态变化如何对神经元的基本功能产生影响。我们发现,即使在没有外部刺激的情况下,MPS也表现出广泛的动态变化,其局部区域会经历分解和重组的循环。
为了确定驱动这些动态变化的因素,我们研究了多种细胞内通路,发现MPS的重塑是由钙信号激活的一系列酶促过程驱动的。特别是,钙离子内流会激活蛋白激酶C(PKC),导致肌动蛋白封端蛋白——内收蛋白发生磷酸化,进而破坏肌动蛋白环的稳定性,促进MPS的分解。此外,钙离子还会激活钙蛋白酶,降解血影蛋白。
肌动蛋白成核和聚合酶——formin也在这些动态变化中发挥作用,可能通过将内收蛋白从肌动蛋白环上移开,导致MPS不稳定。神经元活动会增强这些动态变化,并且在功能上,我们发现MPS的动态变化会促进轴突中的内吞作用。这些结果表明,MPS的存在可能会抑制需要膜接触或变形的细胞过程,因此必须暂时且局部地去除MPS,以促进这些过程的进行,同时又不影响MPS执行其他功能的能力。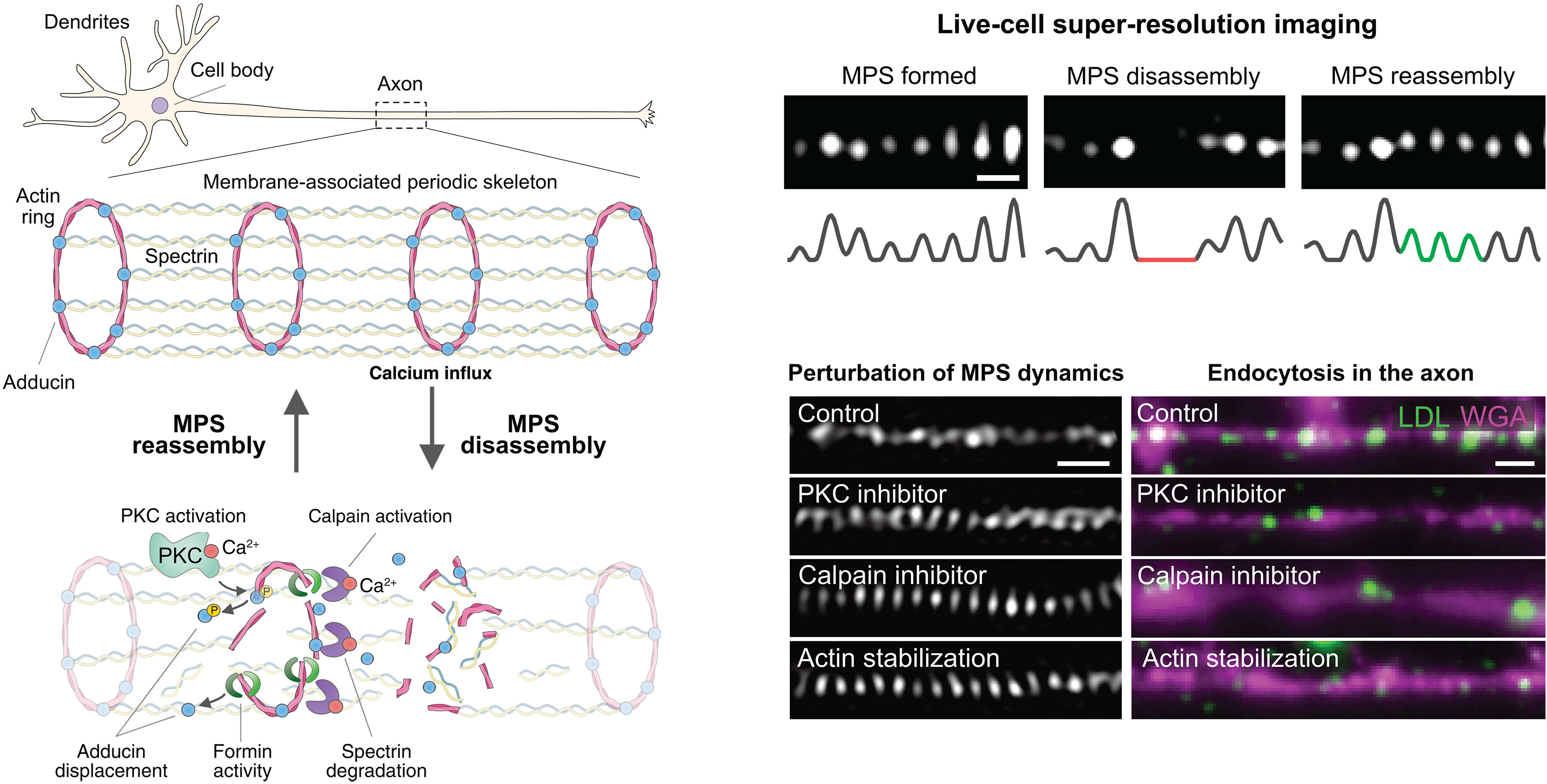
MPS在神经元中具有组成型动态变化。MPS会经历反复的局部分解和重组循环。这些动态变化由钙离子内流驱动,激活蛋白激酶C,使内收蛋白磷酸化并破坏肌动蛋白环的稳定性,同时激活钙蛋白酶降解血影蛋白。这些事件进而导致MPS的降解。在功能上,MPS的动态变化增强了神经元的内吞作用。
参考原文:https://www.science.org/doi/10.1126/science.adn6712
注:图片来源网络,如有侵权请及时联系删除!