来源: 国家药品监督管理局
来源: 国家药品监督管理局仑卡奈单抗——首款在国内上市的治疗阿尔茨海默病的抗Aβ药物
2024年1月09日,国家药品监督管理局通过优先审评审批程序批准Eisai Inc.申报的仑卡奈单抗注射液(商品名:乐意保/Leqembi)上市。
仑卡奈单抗注射液是一种人源化免疫球蛋白IgG1单克隆抗体,可直接拮抗聚集的可溶性和不溶性Aβ,从而减少Aβ斑块。用于治疗由阿尔茨海默病引起的轻度认知障碍和阿尔茨海默病轻度痴呆。
相关研究
2022年底,研究人员在于旧金山召开的CATD大会上公布了的仑卡奈单抗治疗早期阿尔茨海默病的3期临床研究——Clarity AD研究的数据,相关研究论文同步发表在《新英格兰医学杂志》(NEJM)上[3]。
Clarity AD是一项为期18个月的多中心双盲3期临床试验,纳入了1795名50-90岁早期阿尔茨海默病患者,即经PET扫描或脑脊液证据确诊的阿尔茨海默病相关轻度认知障碍或轻度痴呆患者。
参与者随机分配至治疗组和安慰剂组,接受10mg/kg/双周静脉注射治疗,主要终点为临床痴呆评定量表各项评分之和(CDR-SB)评分较基线变化,次要终点为PET检测的淀粉样蛋白负荷变化和ADAS-cog14、ADCOMS、ADCS-MCI-ADL量表评分变化。
两组患者基线CDR-SB评分均为3.2,符合早期AD标准范围(0.5-6)。18个月时,治疗组CDR-SB评分为1.21,安慰剂组为1.66,绝对差值-0.45,评分下降延缓了27%。其他三项认知/行为评估结果也显示,仑卡奈单抗带来了显著的改善。
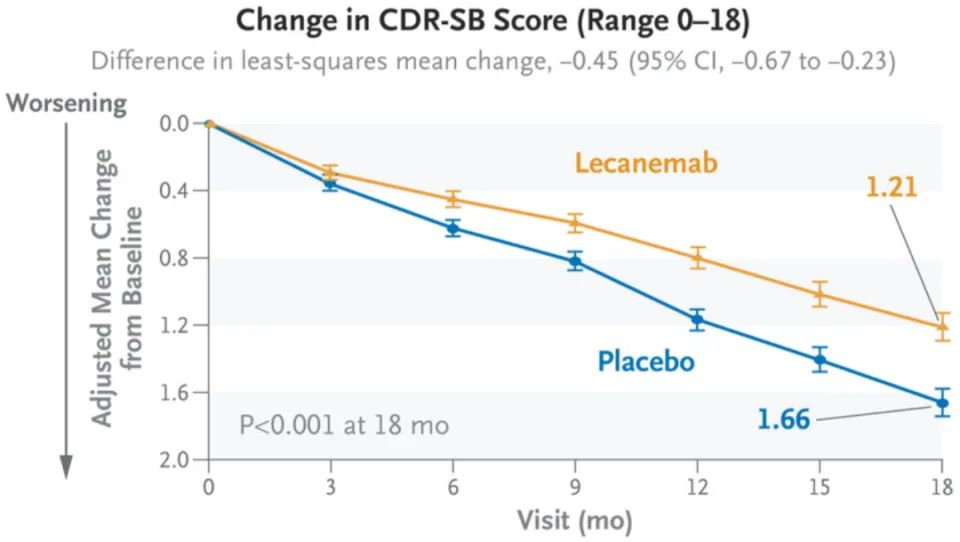
治疗组CDR-SB评分下降显著延缓
有698名患者接受了PET检查,18个月时治疗组脑内淀粉样蛋白负担变化为-55.48 centiloids,安慰剂组则为3.64 centiloids,可见仑卡奈单抗有效地清除了患者脑内的蛋白斑块。
而对脑脊液和血浆生物标志物的分析则显示,除脑脊液NfL外,治疗组所有指标均有改善。研究者认为,脑脊液NfL对神经退行性疾病并不敏感,可能需要更长时间才能观察到数值的变化。
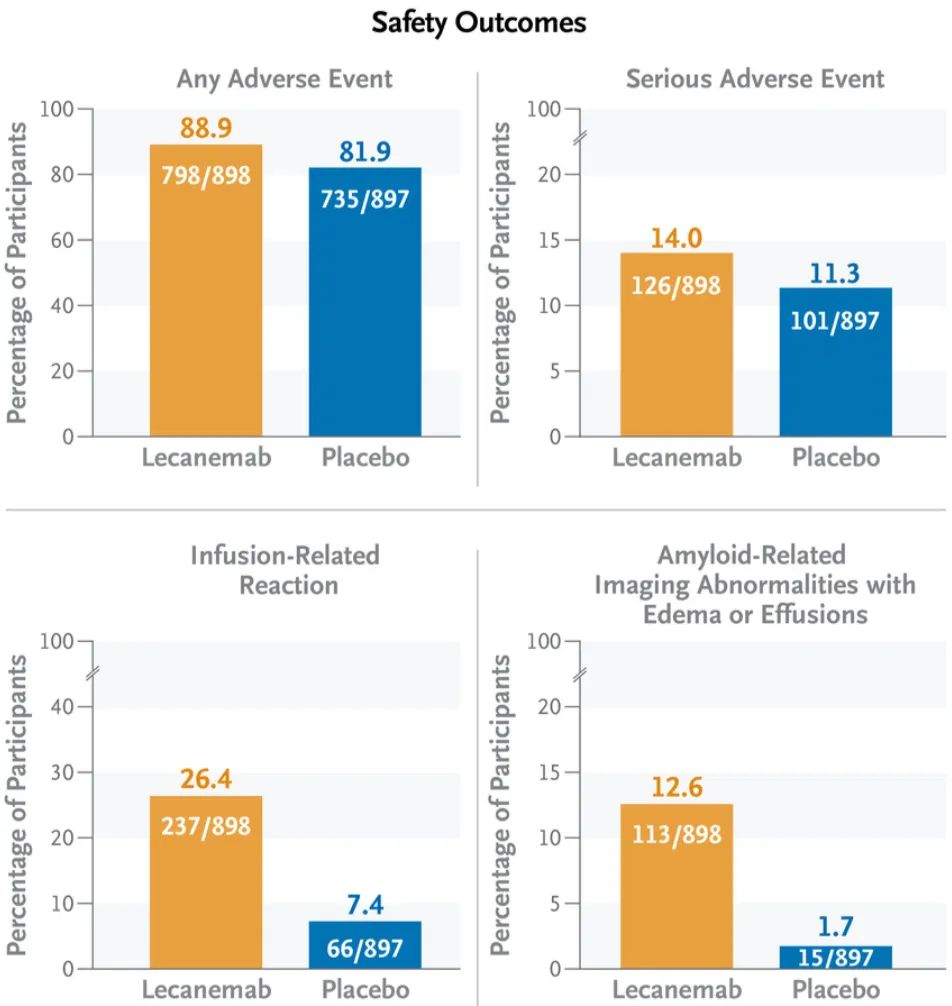
在安全性方面,仑卡奈单抗治疗组死亡率为0.7%,安慰剂治疗组为0.8%。不过,研究人员认为所有死亡均与仑卡奈单抗无关,也不是在出现淀粉样蛋白相关影像学异常(ARIA)的情况下发生。
仑卡奈单抗组最常见的不良事件(发生率>10%)为输液相关反应、ARIA-H、ARIA-E、头痛和跌倒。仑卡奈单抗治疗组最常报告的严重不良事件为输液相关反应(1.2%)、ARIA-E(0.8%)、心房颤动、晕厥和心绞痛。
值得注意的是,根据影像学数据,91%的ARIA-E为轻度至中度,78%无症状,71%发生在治疗的前三个月,81%在发生4个月内消退。
安全性数据
毫无疑问,仑卡奈单抗在中国的获批,会给我国阿尔茨海默病患者带来新的治疗选择。
参考文献:
[1].https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20240109140359178.html
[2].https://www.fda.gov/news-events/press-announcements/fda-converts-novel-alzheimers-disease-treatment-traditional-approval
[3].van Dyck CH, Swanson CJ, Aisen P, et al. Lecanemab in Early Alzheimer's Disease. N Engl J Med. 2023;388(1):9-21. doi:10.1056/NEJMoa2212948
图文来源:国家药品监督管理局、奇点网
封面图来源:网络
如有侵权请及时联系删除!