来源: Science Advances
来源: Science Advances Science Advances丨复旦大学戚建团队发现带miRNA的放生纳米颗粒协调肠道微生物可调节炎症性肠病
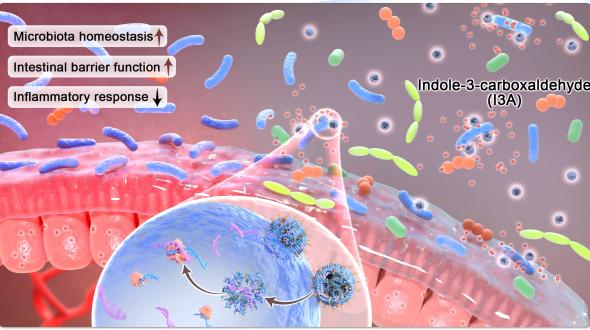
调节肠道微生物群已成为治疗炎症性肠病(IBD)的有前景策略。然而,现有的益生菌和粪便微生物移植等干预措施仍受限于安全性和疗效不足。为此,利用miRNA载氧生物仿纳米颗粒工程化共生的Lactobacillus rhamnosus(LGG),以增强其增殖和吲哚-3-羧醛的产生。通过将来自LGG的细菌细胞外囊泡(BEVs)与脂质纳米颗粒(LNPs)功能化,开发出比大肠杆菌更强的对LGG靶向效率的BEV-LNPs。体外和体内研究显示,BEV-LNPs在模拟生理体液和胃肠道环境中的稳定性优于传统LNP。当与5-氨基水杨酸结合时,BEV-LNP配方在急性和慢性结肠炎模型中显著改善了结局,减少炎症,恢复上皮屏障完整性,并促进微生物平衡。本研究通过利用miRNA载荷纳米颗粒,提出了一种有效的结肠炎治疗策略。
2025年11月21日,复旦大学戚建团队在Science Advances发表题为“miRNA-loaded biomimitic nanoparticles orchestrate gut microbe to ameliorate inflammatory bowel disease”的研究论文,成功开发了一种针对肠道共生菌LGG的仿生纳米递送系统。构建的递送平台通过调节肠道微生物群组成、促进有益微生物代谢物的生物合成以及全面恢复肠道屏障稳态,展现了多维治疗效果。这一创新方法极大提升了5-ASA在IBD治疗中的疗效。有可能通过肠道微生物的协调,为IBD管理提供了另一种选择。

炎症性肠病(IBD)是一系列慢性和复发的胃肠道疾病,发病率正在上升。IBD全球患病率估计在600万到800万之间,主要包括溃疡性结肠炎和克罗恩病,这两种疾病都会引起血性腹泻、腹部痉挛和肠穿孔等痛苦。一线和二线临床治疗包括5-氨基水杨酸(5-ASA)、皮质类固醇、免疫抑制剂以及抗肿瘤坏死因子-α(TNF-α)单克隆抗体。然而,这些干预主要起到抗炎作用和缓解症状,未能实现疾病的完全缓解。此外,这些治疗伴随着若干限制,如严重副作用、病灶处药物积累有限、原发无效和继发无效。因此,炎症性肠病缓解的替代治疗范式当下迫切需要。
人类胃肠道(GIT)拥有复杂的微生物群,包含数万亿微生物,这些微生物在维持宿主稳态中起着关键作用。该微生物群落的菌群失调是炎症性肠病的标志,表现为有益细菌减少和致病菌过度生长。这种失衡破坏了黏膜完整性,导致黏蛋白层变薄并增加肠道通透性。致病细菌侵入肠壁,引发异常的黏膜免疫反应,包括促炎T辅助细胞的过度活化和调节性T细胞的抑制。炎症性细胞因子和趋化因子的过度产生引发了一系列病理事件,最终导致肠道损伤、慢性炎症以及如狭窄和结直肠癌等纤维化并发症。除了免疫失调,微生物失衡还会改变肠道衍生化合物的代谢谱,包括短链脂肪酸、色氨酸代谢物和硫化氢(H2S),这可能促成疾病进展。
为应对这些挑战,研究人员探索了多种调节肠道微生物群的治疗方法,包括工程益生菌、粪便微生物移植(FMT)、钨基纳米递送系统和外泌体。尽管在工程益生菌递送方面取得了诸多进展,但口服后失活、免疫识别细菌抗原以及肠道腔的定植仍是挑战。
关于FMT,它会引起许多不良反应,如鼻空肠管呼吸阻塞、吞服胶囊后恶心呕吐,以及结肠镜后腹泻。其次,FMT的成分复杂,存在病原体在个体间传播的风险。关于外泌体,大量文献报告称,来自药用或食用植物、牛奶和哺乳动物细胞的外泌体可能通过内部微小RNA(miRNA)逆转肠道微生物群失衡并缓解结肠炎。研究表明,miRNA跨界调控肠道细菌、哺乳动物细胞、真菌或其他物种的靶基因表达,从而发挥药理活性。例如,来自姜外泌体的mdo-miR-7267-3p会被共生细菌鼠梨乳杆菌(Lactobacillus rhamnosus,LGG)有利地内吞,并下调单加氧酶ycnE,从而促进肠道屏障的恢复和结肠炎的缓解。然而,外泌体中包含的miRNA功能丰富且副作用难以预测。此外,耗时的提取过程、难以控制的质量控制以及储存稳定性差也阻碍了外泌体的开发。
鉴于这些限制,先进纳载载系统的开发已成为一个有前景的替代方案。膜仿生纳米颗粒通过膜融合或涂层将各种来源的细胞膜改造到纳米颗粒上,从而实现原始细胞膜表面蛋白质和脂质的遗传。这一策略赋予纳米颗粒此前未知的生物功能,比如能够靶向亲本细胞,使其能够穿越生物屏障,在目标位点有效积累,而不影响药物加载能力。 现在,细菌细胞外囊泡(BEVs)被用来修饰纳米颗粒。BEV能够将包括脂质、蛋白质、核酸、细胞毒素和信号分子在内的多种物质通过细菌膜运输,促进细菌间复杂的通信。已有文献证明,BEVs可以介导同一物种细菌之间的横向基因转移。同源定向被认为是潜在机制。仿生纳米颗粒的同源靶向机制本质上依赖于通过细胞膜成分模拟自然相互作用。通过保留膜表面的特征性蛋白质、抗原或受体,这些纳米颗粒特异性结合目标细胞上的对应分子,实现精确识别、内化和药物释放。例如,有研究人员设计了一种细菌外膜囊泡包覆中孔硅纳米颗粒药物递送系统。通过将BEVs与亲本细菌融合,抗菌药物利福平成功地被递送到大肠杆菌(EcN)细胞质中,该药物对革兰氏阴性菌感染无效,即使在低剂量下也具有显著的抗菌活性。
在此,考虑到微生物群的关键作用及miRNA的治疗潜力,我们假设将mdo-miR-7267-3p传递给LGG将促进其增殖并增强有益代谢物的产生。预计通过恢复肠道微生物群稳态、重建上皮屏障和缓解异常肠道免疫反应,结肠炎有望得到改善。脂质纳米颗粒(LNPs)被用来包裹miRNA,以增强细菌的摄取和转化率。为了不干扰其他细菌,LGG中的BEV与LNP融合以实现同源靶向。首先,为了最大化细菌的摄取效率,筛选了不同大小和表面电荷的LNP。随后,BEV的混合LNPs(BEV-LNPs)被制备以验证LGG的同源靶向效应。对口服给药后BEV-LNP在GIT中的稳定性和安全性进行了探讨。最后,在右旋糖硫酸钠盐(DSS)诱导急性结肠炎模型和IL-10缺陷慢性结肠炎模型中,研究了BEV-LNP的治疗效果(见图1)。
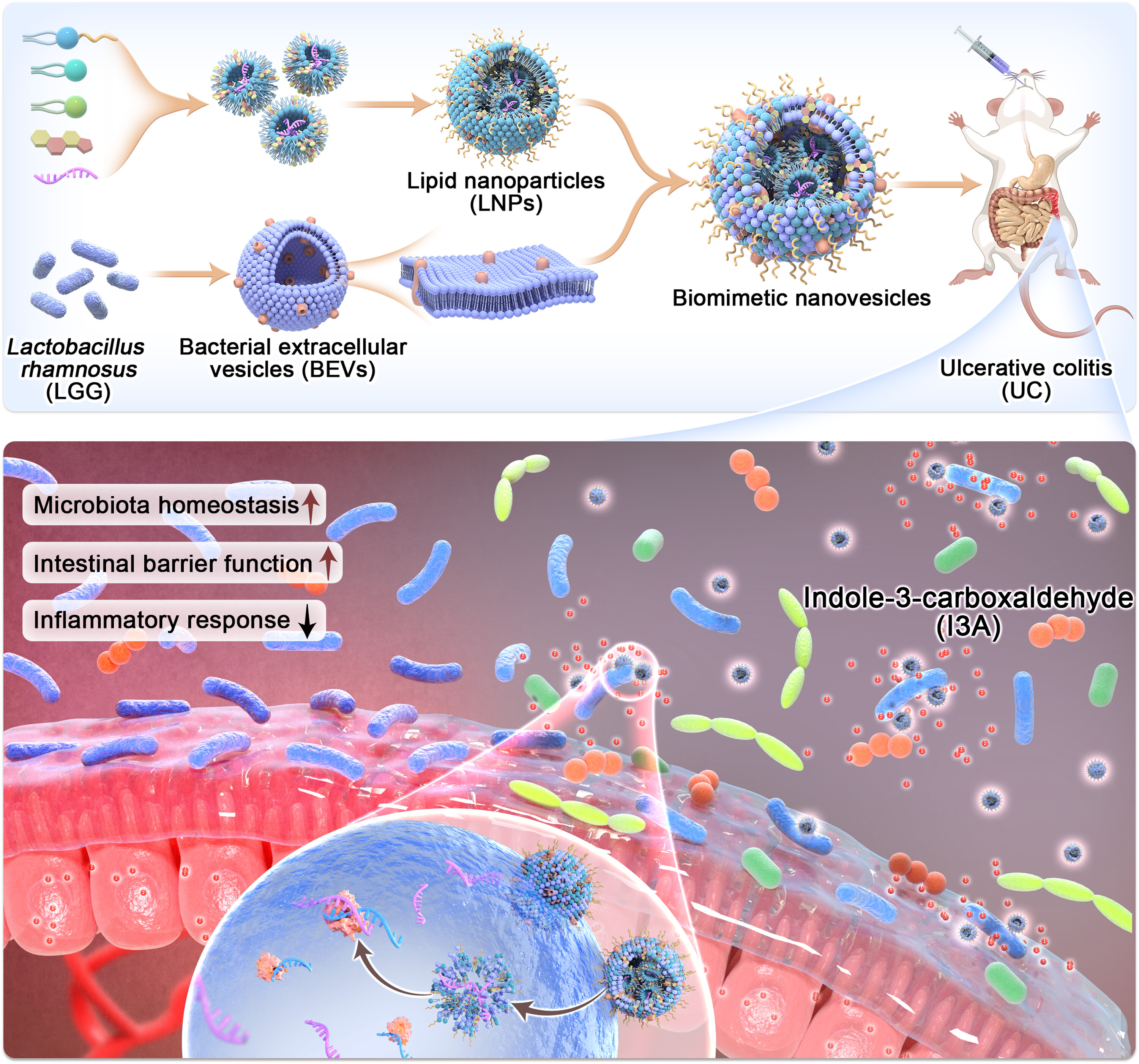
迄今为止,肠道微生物群不仅成为肥胖、非酒精性脂肪肝炎和阿尔茨海默病的重要靶点,也成为炎症性肠病的重要靶点。鉴于炎症性肠病仍未达到令人满意的治疗效果以及肠道菌群失调的负面作用,本研究创新地将注意力从传统的药物吸收和分发促进转向调控关键肠道微生物。在多种肠道微生物中,共生性LGG因其优异的安全性而备受关注。此前,益生菌涂层策略被巧妙地构建,用于增强递送稳定性和延长局部保留以治疗IBD。
在此,我们没有口服纯净或涂层益生菌,而是用miRNA原位作LGG,以避免口服益生菌在消化道上的破坏和结肠定殖受限的问题。据我们所知,关于miRNA影响细菌生长和控制肠道微生物菌群失调的研究仍然稀少。16S rRNA基因分析结果表明,无论健康小鼠还是患病小鼠,LGG的患病率均有所提升。此外,肠道微生物群的整体结构得到了改善。肠道微生物群导向疗法的潜在机制被广泛研究,包括分泌有利信号分子、训练免疫系统以及恢复肠道上皮屏障。
尽管miRNA模拟物缓解了稳定性和亲和力问题,但进入细菌仍是小核酸递送的主要瓶颈。为了穿越细菌包膜屏障,带负电的miRNA需要克服带负电的脂多糖/聚酸的静电排斥、肽聚糖层的尺寸过滤效应以及脂质双层的阻断。为此,我们解决了通过仿生纳米颗粒将miRNA作为治疗药物传递给特定肠道微生物的难题,因为miRNA的摄取效率更高。
本研究成功开发了一种针对肠道共生菌LGG的仿生纳米递送系统。构建的递送平台通过调节肠道微生物群组成、促进有益微生物代谢物的生物合成以及全面恢复肠道屏障稳态,展现了多维治疗效果。这一创新方法极大提升了5-ASA在IBD治疗中的疗效。我们的工作有可能通过肠道微生物的协调,为IBD管理提供了另一种选择。
文章来源:https://www.science.org/doi/10.1126/sciadv.adw5984
图片来源网络如有侵权请及时联系删除!