来源: Nature
来源: NatureNature丨小鼠肝脏和肠道的空间代谢梯度,确认果糖诱发的肝脏代谢局灶性异常
在哺乳动物中,组织代谢由饮食或器官间交换带来的循环营养物质驱动。小肠参与消化、营养吸收和膳食营养素的初始处理。肝脏处理膳食营养素和异种生物,调节全身碳水化合物、脂肪和蛋白质的新陈代谢,肠道和肝脏共同塑造全身代谢稳态。
组织功能取决于其空间结构。在肝脏中,细胞被空间组织为重复的六角形小叶,富含营养且含氧的血液从小叶角的门结通过小叶渗入引流的中央静脉。这种空间布局会诱导沿门静脉-中心轴线的营养和氧浓度梯度。肝细胞基因表达也沿该轴变化,这种分区有助于肝脏同时执行多种生理过程,其中一些功能上是相互作用的。在小肠中也观察到空间基因表达梯度。在那里,分化的上皮细胞起源于窝穴,并向绒毛尖端迁移。沿着绒毛轴线的细胞暴露于血液从绒毛腔流向绒毛尖端时,循环化合物的浓度梯度。因此,基因表达和营养获取都可能对肝脏和肠道的空间代谢组织有所贡献。
哺乳动物细胞的性质取决于它们在器官中的位置。肝脏中的基因表达在门膜周围和中央周围肝细胞之间有所不同,以及肠道中从穴穴到绒毛尖端的分布,组织空间组织的关键因素可能是代谢因素,但对空间代谢的直接评估仍然有限。
2025年10月15日,普林斯顿大学Joshua D. Rabinowitz团队在Nature 在线发表题为“Spatial metabolic gradients in the liver and small intestine”的研究论文,该研究绘制了小鼠肝脏和肠道的空间代谢梯度。研究人员利用矩阵辅助激光解吸/电离(MALDI)成像质谱(IMS)、同位素示踪和深度学习人工智能开发了一个集成的实验-计算工作流程。
研究人员绘制了小鼠肝脏和肠道的空间代谢梯度,开发了一套结合基质辅助激光脱附/电离(MALDI)成像质谱(IMS)、同位素追踪和深度学习人工智能的综合实验-计算工作流程。
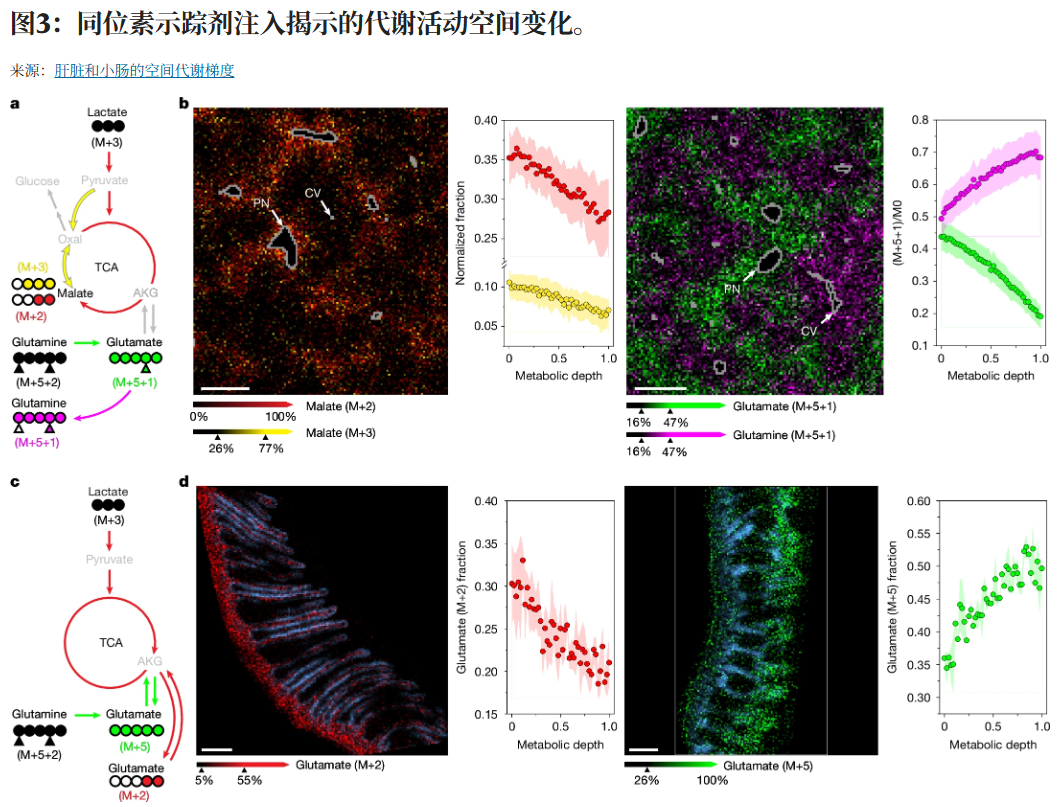
大多数测得的代谢物(>90%)在肝叶和肠道绒毛中显示出显著的空间浓度梯度。在肝脏中,三羧酸(TCA)循环代谢物及其谷氨酰胺和乳酸的同位素标记均定位于门膜周围。能量应激代谢产物,包括腺苷单磷酸(AMP),也局限于门膜周围,符合门膜周围高能量需求。肠道中,TCA中间体苹果酸盐(尖端)和柠檬酸盐(窝沟)显示出相反的空间模式,基于同位素追踪,尖端中谷氨酰胺分解作用较高,窝穴中乳酸氧化。
最后,研究团队绘制了肥胖性膳食糖果糖的命运。肠道内,口服果糖在绒毛底部的分解速度快于末端。在肝脏中,果糖来源的碳在中心周积累为果糖-1-磷酸,并引发中央腺苷三连酸(ATP)的耗竭。因此,本研究既提供了肠道和肝脏代谢组织的基础知识,也识别了果糖诱发的肝脏代谢局灶性异常。
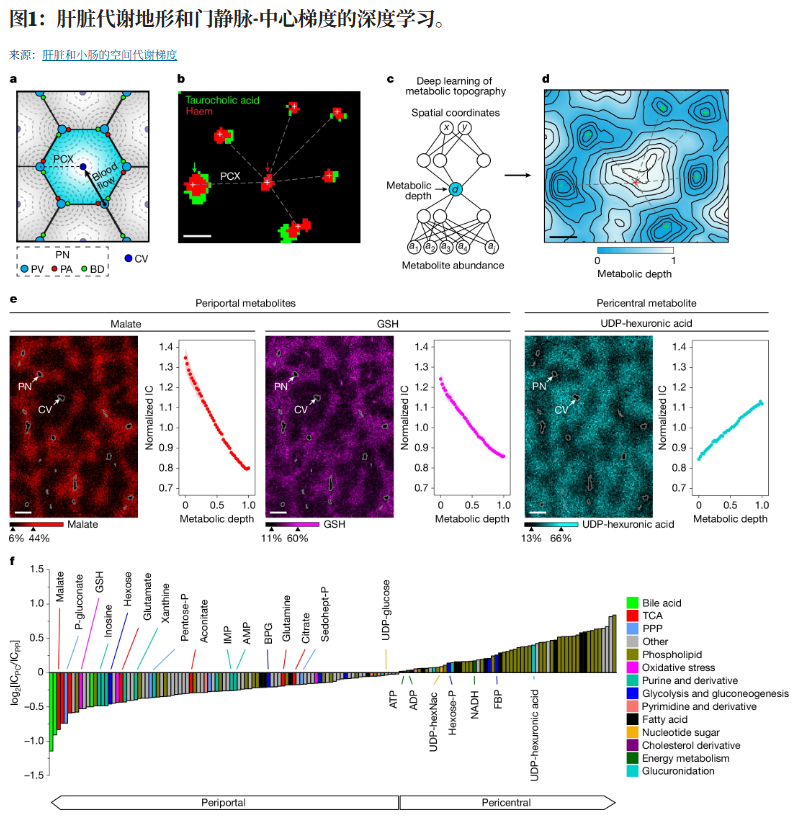
肝脏和小肠的代谢分区此前主要通过基因和蛋白质表达推断。然而,基因表达并不总是反映细胞表型。蛋白质和转录本水平的空间分布相关性较弱,酶水平只能部分解释代谢活动。因此,需要直接的代谢测量。迄今为止,肝脏代谢组学已在低空间分辨率(≥30微米)下获得,且未定量门静脉-中心梯度,除了少数通过二级离子质谱测量的代谢物外,这种技术具有微米级空间分辨率但代谢组覆盖有限,缺乏肠道代谢梯度的空间测量。
除了代谢物丰度之外,理解代谢活动的空间价值也很重要。单靠代谢物水平无法反映通路活性。因为代谢物丰度较高可以归因于更快的生产或较慢的消耗。稳定同位素追踪与IMS的结合在这方面具有潜力,但迄今为止仅在低空间分辨率下实现。
研究中利用MALDI-IMS(肝脏15微米,肠道10微米和5微米)高空间分辨率绘制代谢物丰度和途径活性图。研究团队开发了一种深度学习方法,通过代谢组图像推断出主要的潜在空间模式(代谢地形)。分析显示,超过90%的代谢物在肝脏的门-中央轴和肠道的窝-绒毛轴上存在显著变化。我们还进一步展示了这些浓度梯度背后的代谢活动模式,以及肥胖性膳食营养素果糖对或许最基本代谢产物ATP水平的局部破坏。
研究团队将MALDI-IMS与深度学习结合,测量空间代谢梯度。MALDI-IMS是一种越来越普及的工具,但它的空间分辨率和信噪比有限,信号随空间分辨率的平方下降。通过精心的样品准备,分别以15微米和10微米的空间分辨率捕获肝脏和肠道代谢物,足以辨识组织学标志、经典梯度以及肠上皮单细胞层。这种空间分辨率的代价是信噪比相对较低,像素间信号变异较大。在计算上,通过对平均的创新,利用深度学习从每张图像数千个MALDI像素的数据中辨别出最强的地形代谢模式,来应对这种精度不足。展望未来,可预见像素平均依然重要,有潜力超越代谢梯度,捕捉单个细胞类型,可能借助多组学成像。
关于塑造空间代谢梯度的因素,其中一个因素是酶表达,这与肝脏谷氨酰胺代谢梯度、TCA循环原料和糖新生相符。另一个是代谢需求。肝脏和肠道中富含线粒体的区域能量电荷出人意料地降低,反映了需求控制能量代谢物水平的能力。底材和氧气的可用性也很重要。例如,在肠道中,柠檬酸盐强烈定位于富含氧气的窝穴,尽管其合成酶定位于绒毛尖端。最后,随着膳食营养从肠道腔体进入全身循环,会产生代谢梯度。
为了监测过程,我们用同位素标记的果糖在小鼠身上加肚。在肠道中,果糖代谢最快发生在绒毛底部,而非几何特权的顶端。未加工的果糖通过肝脏进入肝脏,首先进入门膜周围细胞,这些细胞能够分解果糖,将其转化为F1P、三碳单位,最终转化为糖原。因此,哺乳动物通过肠道和门膜周围代谢的结合进化出了清除果糖的能力。然而,对于大量口服果糖,会溢出到中央肝脏。由于F1P清除酶醛醇酶B的中心周层水平较低,这导致F1P的积累,这是一种强力的脂肪生成信号。这种部分果糖代谢也会消耗ATP,导致周围ATP的消耗。这种果糖摄入的解剖学测序具有使F1P介导的脂肪生成反应对肠道清除的少量果糖(例如春季初果)不敏感,而对大量到达中央肝脏的果糖(例如秋季丰盛果实)则异常敏感,满足了进化上在糖分过剩时选择性储存脂肪的需求。
总体而言,本研究提供了关于肝脏和小肠代谢物浓度梯度的基础数据,并辅以同位素示踪研究。能够在空间上追踪膳食营养素的命运,应当广泛应用于果糖之外。更广泛地说,这里提出的方法有望绘制涵盖广泛器官的代谢梯度,包括由年龄和疾病引发的变化。
文章来源:https://www.nature.com/articles/s41586-025-09616-5#Abs1
图片来源网络如有侵权请及时联系删除!